吕农华教授团队发现:思连康可改善幽门螺杆菌根除治疗患者的唾液、胃肠道菌群环境,减少不良反应发生

研究结果显示,思连康双歧杆菌四联活菌片可改善幽门螺杆菌根除治疗患者的唾液、胃肠道菌群环境,减少不良反应发生。
幽门螺杆菌,全球感染传播最广泛的细菌之一,在全球人口中约有50%的患病率[2]。感染幽门螺杆菌可能导致慢性胃炎,并增加消化性溃疡、胃癌和黏膜相关淋巴组织淋巴瘤的患病风险。截至目前,含铋剂的四联疗法已成为国际范围内认可的幽门螺杆菌治疗一线用药方案[3],然而进一步研究发现,四联药物的使用,会导致患者胃肠道不良反应及肠道菌群的短期紊乱[4, 5]。

已有研究证实,联合益生菌可减轻铋剂四联药物所引起的胃肠道不良反应[6, 7],并有助于铋剂四联药物治疗后胃、肠道菌群中有益菌谱的重构[8]。因此,探讨思连康双歧杆菌四联活菌片对于幽门螺杆菌根除后患者胃肠道菌群的影响具有深远意义,值得关注。
南昌大学第一附属医院吕农华教授牵头,包括西安市中心医院、山西医科大学第一附属医院、郑州大学第五附属医院、云南省第一人民医院、南京医科大学附属南京医院及浙江中医药大学第一附属医院在内的全国七家三甲医院共同开展了一项为期两年八个月的多中心、随机、双盲、安慰剂对照研究,并在2022年11月Frontiers in Immunology(IF:8.786)发表了题为”Probiotics modulate gastrintestinal microbiota after Helicobacter pylori eradication:A multicenter randomized double-blind placebo-controlled trial”的研究论文。旨在进一步明确思连康双歧杆菌四联活菌片联合14天含铋剂四联疗法根除幽门螺杆菌的疗效和安全性,以及对胃肠道菌群变化的影响。
研究纳入诊断为慢性胃炎且幽门螺杆菌检测呈阳性的成年患者(18-65岁)。以1∶1的比例将符合条件的患者随机分配至双歧杆菌四联活菌片组或安慰剂组。两组患者均接受14天含铋剂四联疗法(埃索美拉唑 20 mg 、阿莫西林1000 mg 、呋喃唑酮 100 mg 、枸橼酸铋钾 220 mg ,早晚各给药),同时联合双歧杆菌四联活菌片(思连康,杭州远大生物制药有限公司,中国杭州)或安慰剂(9片/次,中午顿服),疗程4周。并于基线筛查(T1)、14天根除治疗结束时(T2)、双歧杆菌四联活菌片/安慰剂治疗结束时(T3)、根除后8周(T4)和根除后24周(T5)的5次访视时进行评估。
结果显示:
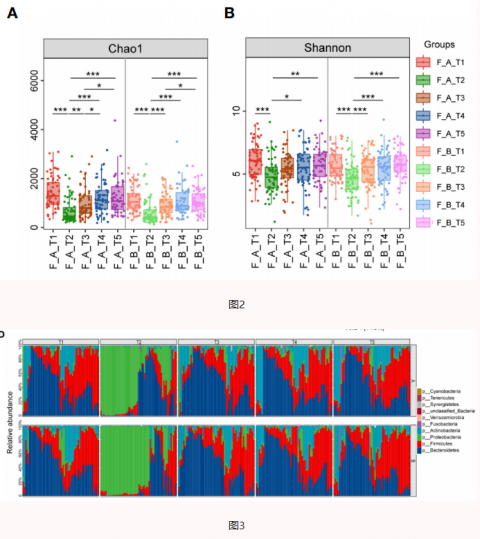
思连康双歧杆菌四联活菌片组胃肠道不良反应发生率低于安慰剂组(23.6% vs 37.7%,p =0.016)。除此之外,在根除后,肠道菌群结构发生了剧烈的变化,变形菌门取代了共生厚壁菌门和拟杆菌门,并在两周后逐渐恢复。补充思连康双歧杆菌四联活菌片可中和根除药物所带来的肠道拟杆菌门的减少,使胃菌群的波动更加平稳,抑制口腔致病菌的生长。
01思连康减少Hp根除后不良反应
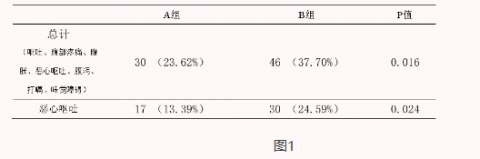
与安慰剂组相比,双歧杆菌四联活菌片组胃肠道不良反应的总体发生率显著降低(23.62% vs 37.7%,p =0.016),且安慰剂组恶心呕吐发生率高于双歧杆菌四联活菌片组(24.59% vs 13.39% ,p =0.024)(图1)。
02思连康缓解Hp根除后的肠道菌群紊乱
03思连康可使Hp根除后胃菌群波动减小
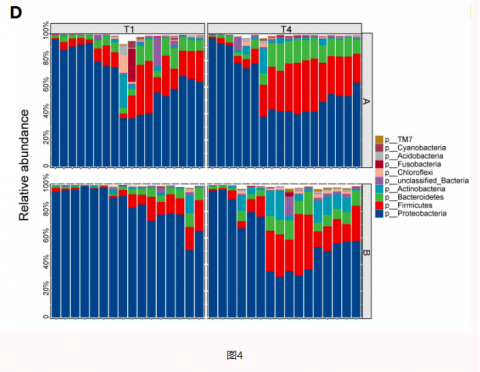
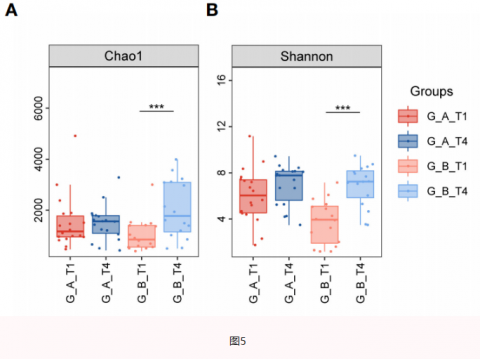
04思连康可抑制Hp根除后口腔致病菌生长
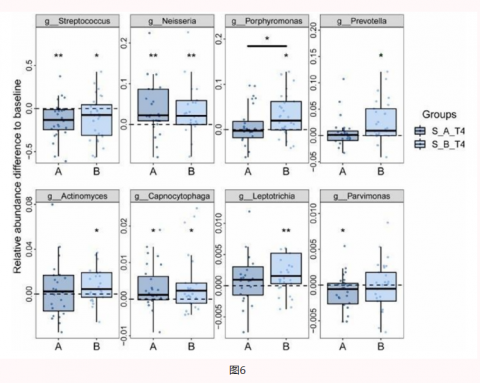
越来越多的证据提示,根除幽门螺杆菌感染的铋剂四联疗法会导致肠道菌群稳态的短期受损。《第六次全国幽门螺杆菌感染处理共识报告》明确指出,根除治疗可改变肠道微生物种群的多样性和结构。

本次研究显示:
顿服思连康双歧杆菌四联活菌片,可降低胃肠道不良反应的发生率。
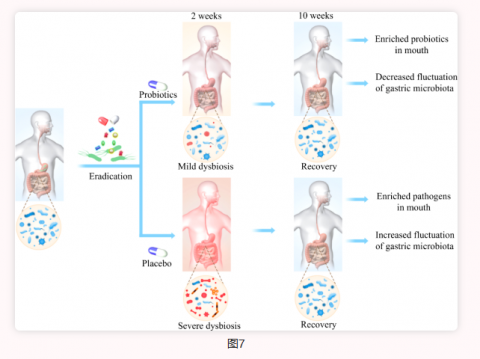
根除幽门螺杆菌后,唾液、胃和肠道的微生物菌群组成发生显著变化,停用抗生素两周后肠道菌群恢复到基线水平。通过顿服思连康双歧杆菌四联活菌片治疗,可使微生物菌群的紊乱得到缓解(图7)。这为幽门螺杆菌治疗方案的进一步优化以及副作用的减轻提供了新的临床应用方向和思路。
[1] YUAN Z, XIAO S, LI S, et al. The impact of Helicobacter pylori infection, eradication therapy, and probiotics intervention on gastric microbiota in young adults [J]. Helicobacter, 2021, 26(6): e12848.
[2] SALAMA N R, HARTUNG M L, MüLLER A. Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori [J]. Nature reviews Microbiology, 2013, 11(6): 385-99.
[3] BANG C S, LIM H, JEONG H M, et al. Amoxicillin or tetracycline in bismuth-containing quadruple therapy as first-line treatment for Helicobacter pylori infection [J]. Gut microbes, 2020, 11(5): 1314-23.
[4] YE Q, SHAO X, SHEN R, et al. Changes in the human gut microbiota composition caused by Helicobacter pylori eradication therapy: A systematic review and meta-analysis [J]. Helicobacter, 2020, 25(4): e12713.
[5] CHEN C C, LIOU J M, LEE Y C, et al. The interplay between Helicobacter pylori and gastrointestinal microbiota [J]. Gut microbes, 2021, 13(1): 1-22.
[6] ZHAO Y, YANG Y, ARUNA, et al. Saccharomyces boulardii Combined With Quadruple Therapy for Helicobacter pylori Eradication Decreased the Duration and Severity of Diarrhea: A Multi-Center Prospective Randomized Controlled Trial [J]. Frontiers in medicine, 2021, 8: 776955.
[7] PLOMER M, III PEREZ M, GREIFENBERG D M. Effect of Bacillus clausii Capsules in Reducing Adverse Effects Associated with Helicobacter pylori Eradication Therapy: A Randomized, Double-Blind, Controlled Trial [J]. Infectious diseases and therapy, 2020, 9(4): 867-78.
[8] YANG C, LIANG L, LV P, et al. Effects of non-viable Lactobacillus reuteri combining with 14-day standard triple therapy on Helicobacter pylori eradication: A randomized double-blind placebo-controlled trial [J]. Helicobacter, 2021, 26(6): e12856.
[9]《第六次全国幽门螺杆菌感染处理共识报告》